ZYTOKINE
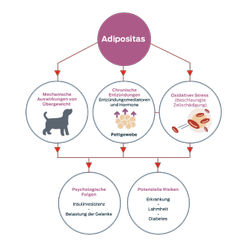
Fettleibigkeit ist definiert als eine übermäßige Ansammlung von Fettgewebe im Körper.1
Das Fettgewebe ist mehr als nur ein Speicher für überschüssige Energie, es ist auch ein aktives endokrines Organ.
Adipozyten (Fettzellen) sondern eine Vielzahl von Hormonen, Zytokinen und anderen Proteinfaktoren ab, die zusammen als Adipokine bezeichnet werden und den Rest des Körpers biologisch beeinflussen.
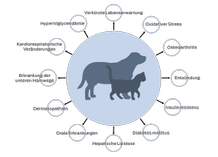
Studien zeigen, dass Fettleibigkeit mit einem Zustand chronischer, geringgradiger Entzündung verbunden ist,2 ein Zustand, der Haustiere für Krankheiten wie Osteoarthritis und Diabetes mellitus prädisponiert.
Der wissenschaftliche Zusammenhang zwischen Fettleibigkeit und Krankheit
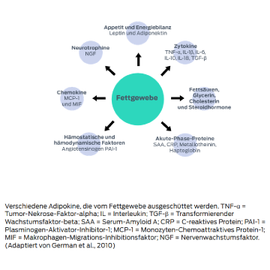
Das Fettgewebe produziert mehr als 100 Adipokine, deren systemische Auswirkungen von der Appetitregulierung bis zum Blutdruck reichen. Dazu gehören entzündungsfördernde Zytokine wie der Tumor-Nekrose-Faktor-α (TNF-α), Interleukin-6 und das C-reaktive Protein.3
Die Sekretion von Adipokinen ist bei Fettleibigkeit verändert. Bei Humanstudien zu Fettleibigkeit wurde festgestellt, dass die Blutspiegel von Entzündungszytokinen systemisch erhöht sind.4 In ähnlicher Weise hat die Forschung von Purina und anderen gezeigt, dass fettleibige Hunde und Katzen im Vergleich zu schlanken Tieren erhöhte Konzentrationen von entzündungsfördernden Adipokinen aufweisen.5–10
Da das Fettgewebe – oder genauer gesagt das weiße Fettgewebe – eine Quelle für diese entzündlichen Verbindungen ist, scheinen erhöhte Werte von entzündlichen Adipokinen eine Verbindung zwischen Fettleibigkeit und vielen gewichtsbedingten Krankheiten zu sein.3,11
Die Insulinresistenz bei Fettleibigkeit ist zum Beispiel mit erhöhten Werten von TNF-α verbunden. TNF-α ist ein Zytokin, das die Aktivierung von Insulinrezeptoren blockiert.12–15
Die Forschungsergebnisse belegen auch, dass Fettleibigkeit mit einer erhöhten Produktion von freien Radikalen einhergeht, was zu einem erhöhten oxidativen Stress führt. Oxidativer Stress trägt zu Gewebeschäden bei, die bei der Entstehung vieler Krankheiten eine Rolle spielen können.16,17
Viele dieser unerwünschten Wirkungen lassen sich durch eine Gewichtsabnahme verringern oder umkehren.5,7,13, 18–20
Das Wichtigste in Kürze
- Das Fettgewebe ist ein aktives endokrines Organ, das Hormone, Zytokine und andere Protein-Faktoren – zusammenfassend Adipokine genannt – absondert, die den gesamten Organismus biologisch beeinflussen.
- Bei Fettleibigkeit sind die Adipokine, die die Insulinresistenz, Entzündungen, den oxidativen Stress und andere biologische Funktionen beeinflussen, verändert.
- Die Gewichtsabnahme ist mit einer Reduzierung der Adipokine verbunden, die Biomarker für Entzündungen sind.
Mehr Informationen zum Thema Gewichtsmanagement für eine gute Gesundheit
Weitere Informationen
- Kopelman, P. G. (2000). Obesity as a medical problem. Nature, 404 (6778), 635–643.
- Trayhurn, P., & Wood, I. S. (2005). Signalling role of adipose tissue: Adipokines and inflammation in obesity. Biochemical Society Transactions, 33(Pt 5), 1078–1081.
- German, A. J., Ryan, V. H., German, A. C., Wood, I. S., & Trayhurn, P. (2010). Obesity, its associated disorders and the role of inflammatory adipokines in companion animals. Veterinary Journal, 185(1), 4–9.
- Zorena, K., Jachimowicz-Duda, O., Ślęzak, D., Robakowska, M., & Mrugacz, M. (2020). Adipokines and obesity. Potential link to metabolic disorders and chronic complications. International Journal of Molecular Sciences, 21(10), 3570.
- Bastien, B. C., Patil, A., & Satyaraj, E. (2015). The impact of weight loss on circulating cytokines in Beagle dogs. Veterinary Immunology and Immunopathology, 163(3–4), 174–182.
- Eirmann, L. A., Freeman, L. M., Laflamme, D. P., Michel, K. E., & Satyaraj, E. (2009). Comparison of adipokine concentrations and markers of inflammation in obese versus lean dogs. International Journal of Applied Research in Veterinary Medicine, 7(4), 196–205.
- Wakshlag, J. J., Struble, A. M., Levine, C. B., Bushey, J. J., Laflamme, D. P., & Long, G. M. (2011). The effects of weight loss on adipokines and markers of inflammation in dogs. The British Journal of Nutrition, 106 Suppl 1, S11–S14.
- Vester, B. M., Sutter, S. M., Keel, T. L., Graves, T. K., & Swanson, K. S. (2009). Ovariohysterectomy alters body composition and adipose and skeletal muscle gene expression in cats fed a high-protein or moderate-protein diet. Animal, 3(9), 1287–1298.
- Park, H.-J., Lee, S.-E., Oh, J.-H., Seo, K.-W., & Song, K.-H. (2014). Leptin, adiponectin and serotonin levels in lean and obese dogs. BMC Veterinary Research, 10, 113.
- Jeusette, I. C., Detilleux, J., Shibata, H., Saito, M., Honjoh, T., Delobel, A., Istasse, L., & Diez, M. (2005). Effects of chronic obesity and weight loss on plasma ghrelin and leptin concentrations in dogs. Research in Veterinary Science, 79, 169–175.
- Laflamme, D. P. (2012). Obesity in dogs and cats: What is wrong with being fat? Journal of Animal Science, 90, 1653–1662.
- Gayet, C., Bailhache, E., Dumon, H., Martin, L., Siliart, B., & Nguyen, P. (2004). Insulin resistance and changes in plasma concentration of TNFalpha, IGF1, and NEFA in dogs during weight gain and obesity. Journal of Animal Physiology and Animal Nutrition, 88(3–4), 157–165.
- Blanchard, G., Nguyen, P., Gayet, C., Leriche, I., Siliart, B., & Paragon, B.-M. (2004). Rapid weight loss with a high-protein low-energy diet allows the recovery of ideal body composition and insulin sensitivity in obese dogs. Journal of Nutrition, 134, 2148S–2150S.
- Miller, C., Bartges, J., Cornelius, L., Norton, N., & Barton, M. (1998). Tumor necrosis factor-alpha levels in adipose tissue of lean and obese cats. The Journal of Nutrition, 128(12 Suppl), 2751S–2752S.
- Plomgaard, P., Bouzakri, K., Krogh-Madsen, R., Mittendorfer, B., Zierath, J. R., & Pedersen, B. K. (2005). Tumor necrosis factor-alpha induces skeletal muscle insulin resistance in healthy human subjects via inhibition of Akt substrate 160 phosphorylation. Diabetes, 54(10), 2939–2945.
- Sonta, T., Inoguchi, T., Tsubouchi, H., Sekiguchi, N., Kobayashi, K., Matsumoto, S., Utsumi, H., & Nawata, H. (2004). Evidence for contribution of vascular NAD(P)H oxidase to increased oxidative stress in animal models of diabetes and obesity. Free Radical Biology & Medicine, 37(1), 115–123.
- Tanner, A. E., Martin, J., Thatcher, C. D., & Saker, K. E. (2006). Nutritional amelioration of oxidative stress induced by obesity and acute weight loss. Compendium on Continuing Education for the Practicing Veterinarian, 28(4 SUPPL.), 72.
- Hoenig, M., Thomaseth, K., Waldron, M., & Ferguson, D. C. (2007). Insulin sensitivity, fat distribution, and adipocytokine response to different diets in lean and obese cats before and after weight loss. American Journal of Physiology – Regulatory, Integrative, and Comparative Physiology, 292, R227–R234.
- German, A. J., Hervera, M., Hunter, L., Holden, S. L., Morris, P. J., Biourge, V., & Trayhurn, P. (2009). Improvement in insulin resistance and reduction in plasma inflammatory adipokines after weight loss in obese dogs. Domestic Animal Endocrinology, 37, 214–226.
- Phungviwatnikul, T., Lee, A. H., Belchik, S. E., Suchodolski, J. S., & Swanson, K. S. (2022). Weight loss and high-protein, high-fiber diet consumption impact blood metabolite profiles, body composition, voluntary physical activity, fecal microbiota, and fecal metabolites of adult dogs. Journal of Animal Science, 100(2), skab379. doi: 10.1093/jas/skab379