CITOCHINE
L'obesità è definita come l'accumulo di una quantità eccessiva di tessuto adiposo nel corpo.1
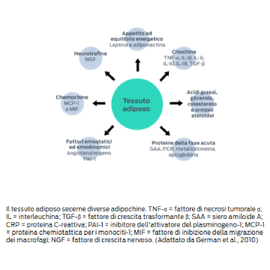
Il tessuto adiposo non solo immagazzina l'energia in eccesso, ma è anche un organo endocrino attivo.
Gli adipociti (cellule adipose) secernono una varietà di ormoni, citochine e altri fattori proteici, collettivamente denominati adipochine, che influenzano biologicamente il resto del corpo.
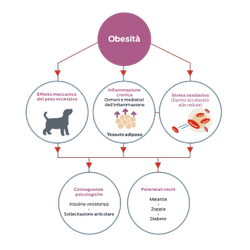
Alcuni studi dimostrano che l'obesità è associata a uno stato di infiammazione cronica lieve,2 una condizione che predispone gli animali domestici a malattie quali osteoartrite e diabete mellito.
Un collegamento basato sulla scienza tra obesità e malattia
Il tessuto adiposo produce oltre 100 adipochine con impatti sistemici che vanno dalla regolazione dell'appetito alla pressione arteriosa. Queste includono citochine pro-infiammatorie quali il fattore di necrosi tumorale α (TNF-α), l'interleuchina-6 e la proteina C-reattiva.3
Nell'obesità, la secrezione delle adipochine risulta alterata. Negli studi sull'obesità nell'uomo, i livelli ematici di citochine infiammatorie appaiono aumentati a livello sistemico.4 Analogamente, una ricerca condotta da Purina e altri ha dimostrato che cani e gatti obesi presentano concentrazioni di adipochine infiammatorie maggiori rispetto agli animali magri.5-10
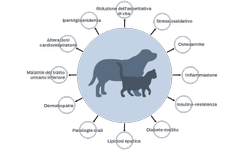
Poiché il tessuto adiposo, o più precisamente il tessuto adiposo bianco, è una fonte di questi composti infiammatori, livelli elevati di adipochine infiammatorie sembrano rappresentare un nesso tra l'obesità e molte malattie correlate al peso.3,11
L'insulino-resistenza nell'obesità, ad esempio, è collegata a livelli elevati di TNF-α, una citochina che blocca l'attivazione dei recettori dell'insulina.12-15
Le ricerche dimostrano inoltre che l'obesità è associata a una maggiore produzione di radicali liberi, che ha come conseguenza un aumento dello stress ossidativo. Lo stress ossidativo contribuisce al danno tissutale che può a sua volta contribuire allo sviluppo di molte malattie.16,17
Molti di questi effetti avversi possono essere ridotti o invertiti con la perdita di peso.5,7,13, 18-20
Aspetti chiave da ricordare
- Il tessuto adiposo è un organo endocrino attivo, che secerne ormoni, citochine e altri fattori proteici, collettivamente denominati adipochine, che influenzano biologicamente il resto del corpo.
- Le adipochine che influiscono su insulino-resistenza, infiammazione, stress ossidativo e altre funzioni biologiche risultano alterate in condizioni di obesità.
- La perdita di peso è collegata a una riduzione delle adipochine, biomarcatori di infiammazione.
Macroaree sulla gestione ottimale del peso
Ulteriori informazioni
- Kopelman, P. G. (2000). Obesity as a medical problem. Nature, 404 (6778), 635–643.
- Trayhurn, P., & Wood, I. S. (2005). Signalling role of adipose tissue: Adipokines and inflammation in obesity. Biochemical Society Transactions, 33(Pt 5), 1078–1081.
- German, A. J., Ryan, V. H., German, A. C., Wood, I. S., & Trayhurn, P. (2010). Obesity, its associated disorders and the role of inflammatory adipokines in companion animals. Veterinary Journal, 185(1), 4–9.
- Zorena, K., Jachimowicz-Duda, O., Ślęzak, D., Robakowska, M., & Mrugacz, M. (2020). Adipokines and obesity. Potential link to metabolic disorders and chronic complications. International Journal of Molecular Sciences, 21(10), 3570.
- Bastien, B. C., Patil, A., & Satyaraj, E. (2015). The impact of weight loss on circulating cytokines in Beagle dogs. Veterinary Immunology and Immunopathology, 163(3–4), 174–182.
- Eirmann, L. A., Freeman, L. M., Laflamme, D. P., Michel, K. E., & Satyaraj, E. (2009). Comparison of adipokine concentrations and markers of inflammation in obese versus lean dogs. International Journal of Applied Research in Veterinary Medicine, 7(4), 196–205.
- Wakshlag, J. J., Struble, A. M., Levine, C. B., Bushey, J. J., Laflamme, D. P., & Long, G. M. (2011). The effects of weight loss on adipokines and markers of inflammation in dogs. The British Journal of Nutrition, 106 Suppl 1, S11–S14.
- Vester, B. M., Sutter, S. M., Keel, T. L., Graves, T. K., & Swanson, K. S. (2009). Ovariohysterectomy alters body composition and adipose and skeletal muscle gene expression in cats fed a high-protein or moderate-protein diet. Animal, 3(9), 1287–1298.
- Park, H.-J., Lee, S.-E., Oh, J.-H., Seo, K.-W., & Song, K.-H. (2014). Leptin, adiponectin and serotonin levels in lean and obese dogs. BMC Veterinary Research, 10, 113.
- Jeusette, I. C., Detilleux, J., Shibata, H., Saito, M., Honjoh, T., Delobel, A., Istasse, L., & Diez, M. (2005). Effects of chronic obesity and weight loss on plasma ghrelin and leptin concentrations in dogs. Research in Veterinary Science, 79, 169–175.
- Laflamme, D. P. (2012). Obesity in dogs and cats: What is wrong with being fat? Journal of Animal Science, 90, 1653–1662.
- Gayet, C., Bailhache, E., Dumon, H., Martin, L., Siliart, B., & Nguyen, P. (2004). Insulin resistance and changes in plasma concentration of TNFalpha, IGF1, and NEFA in dogs during weight gain and obesity. Journal of Animal Physiology and Animal Nutrition, 88(3–4), 157–165.
- Blanchard, G., Nguyen, P., Gayet, C., Leriche, I., Siliart, B., & Paragon, B.-M. (2004). Rapid weight loss with a high-protein low-energy diet allows the recovery of ideal body composition and insulin sensitivity in obese dogs. Journal of Nutrition, 134, 2148S–2150S.
- Miller, C., Bartges, J., Cornelius, L., Norton, N., & Barton, M. (1998). Tumor necrosis factor-alpha levels in adipose tissue of lean and obese cats. The Journal of Nutrition, 128(12 Suppl), 2751S–2752S.
- Plomgaard, P., Bouzakri, K., Krogh-Madsen, R., Mittendorfer, B., Zierath, J. R., & Pedersen, B. K. (2005). Tumor necrosis factor-alpha induces skeletal muscle insulin resistance in healthy human subjects via inhibition of Akt substrate 160 phosphorylation. Diabetes, 54(10), 2939–2945.
- Sonta, T., Inoguchi, T., Tsubouchi, H., Sekiguchi, N., Kobayashi, K., Matsumoto, S., Utsumi, H., & Nawata, H. (2004). Evidence for contribution of vascular NAD(P)H oxidase to increased oxidative stress in animal models of diabetes and obesity. Free Radical Biology & Medicine, 37(1), 115–123.
- Tanner, A. E., Martin, J., Thatcher, C. D., & Saker, K. E. (2006). Nutritional amelioration of oxidative stress induced by obesity and acute weight loss. Compendium on Continuing Education for the Practicing Veterinarian, 28(4 SUPPL.), 72.
- Hoenig, M., Thomaseth, K., Waldron, M., & Ferguson, D. C. (2007). Insulin sensitivity, fat distribution, and adipocytokine response to different diets in lean and obese cats before and after weight loss. American Journal of Physiology – Regulatory, Integrative, and Comparative Physiology, 292, R227–R234.
- German, A. J., Hervera, M., Hunter, L., Holden, S. L., Morris, P. J., Biourge, V., & Trayhurn, P. (2009). Improvement in insulin resistance and reduction in plasma inflammatory adipokines after weight loss in obese dogs. Domestic Animal Endocrinology, 37, 214–226.
- Phungviwatnikul, T., Lee, A. H., Belchik, S. E., Suchodolski, J. S., & Swanson, K. S. (2022). Weight loss and high-protein, high-fiber diet consumption impact blood metabolite profiles, body composition, voluntary physical activity, fecal microbiota, and fecal metabolites of adult dogs. Journal of Animal Science, 100(2), skab379. doi: 10.1093/jas/skab379